

Se trata de un equilibrio químico homogéneo en fase gaseosa. Es una disociación del tipo
A2 Û 2A,
en la que hay variación en el número de moles. Hay que calcular las constantes de equilibrio Kc y Kp a 600ºC. El problema nos da el número de moles iniciales de Br2(g), 0,2 moles; el grado de disociación para una temperatura de 600 ªC, 0,8 y el volumen del recipiente, 0,5 litros.
Tenemos que aplicar la ley de equilibrio químico o ley de acción de masas que en su forma general para el equilibrio, aA + bB Û cC + dD es:
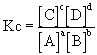
y en función de las presiones parciales:
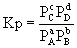
Suponiendo un comportamiento ideal para los gases y teniendo en cuenta la ley de los gases ideales:
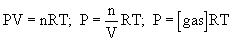
se puede deducir que: Kp = Kc(RT)Dn, siendo Dn = (c+d)-(a+b), la variación en el número total de moles.
Para el equilibrio Br2(g) Û 2 Br(g), el valor de Kc es
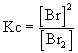
donde [Br] y [Br2] son la concentraciones de las especies en el equilibrio en moles/litro.
Para calcular Kc necesitamos conocer las concentraciones de las sustancias en el equilibrio. Expresaremos éstas en función del número de moles disociados X o del grado de disociación a. Recuerda que:
grado de disociación (a) = nº de moles disociados (X)/nº de moles iniciales.
Como conocemos a utilizaremos en este problema el grado de disociación que indica el numero de moles disociados por cada mol de Br2
Para calcular Kp podemos calcular las presiones parciales en el equilibrio o calcular Kp una vez obtenida Kc utilizando la relación entre Kp y Kc,. Utilizaremos esta segunda estrategia por ser más sencilla.
3. Llevar a cabo el plan de Resolución.
Cuando
se introducen 0,2 moles de Br2(g) en un
recipiente de 0,5 litros a la temperatura de 600 ªC empieza a
disociarse en Br(g), hasta que se establece el equilibrio a esa
temperatura. Según la estequiometria de la
reacción en ese momento se habrán disociado 0,2a moles de Br2
y aparecerán 2(0,2)a
moles de Br en el equilibrio.
| Equilibrio |
|
|
| Nº de moles iniciales | 0,2 | 0 |
| Nº de moles en el equilibrio | 0,2(1-a) | 2(0,2)a |
| Concentración en el equilibrio en moles/litro(siendo el volumen del recipiente 0,5 litros) | 0,2(1-a)/0,5 en moles/litro | 2(0,2)a/0,5 en moles/litro |
| Concentración en el equilibrio a=0,8 | 0,04/0,5 moles/litro
0,08 M |
(0,32)/0,5 moles
/litro
0,64 M |
| presiones parciales en el equilibrio |
PBr2 = 0,08M(RT) |
PBr = 0,64M(RT) |
Sustituyendo en la ecuación de Kc
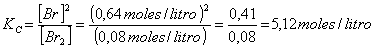
El valor de Kp, según la relación Kp = Kc (RT)Dn, es
Sustituyendo:
Kp = 5,12 moles/litro .(0,082 atm.litro/ºK.mol)(600+273,15)1ºK = 366,58 atm.
Tanto Kc como Kp tienen unidades debido a que en el equilibrio hay variación en el número de moles.
Se
puede comprobar el valor de Kp obteniendo las presiones parciales en el
equilibrio y sustituyendo en la ecuación de Kp
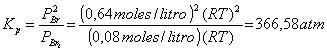
A partir de este dato también se comprobaría el valor de Kc.